[일요주간 = 노현주 기자] 키메라 항원 수용체 T세포(CAR-T) 항암제 ‘킴리아주(티사젠렉류셀)’가 국내 허가를 받았다.
식품의약품안전처는 한국노바티스가 허가 신청한 세계 최초 키메라 항원 수용체 T세포(CAR-T) 치료제 킴리아주를 첨단재생바이오법에 따른 제1호 첨단바이오의약품으로 허가했다고 5일 밝혔다.
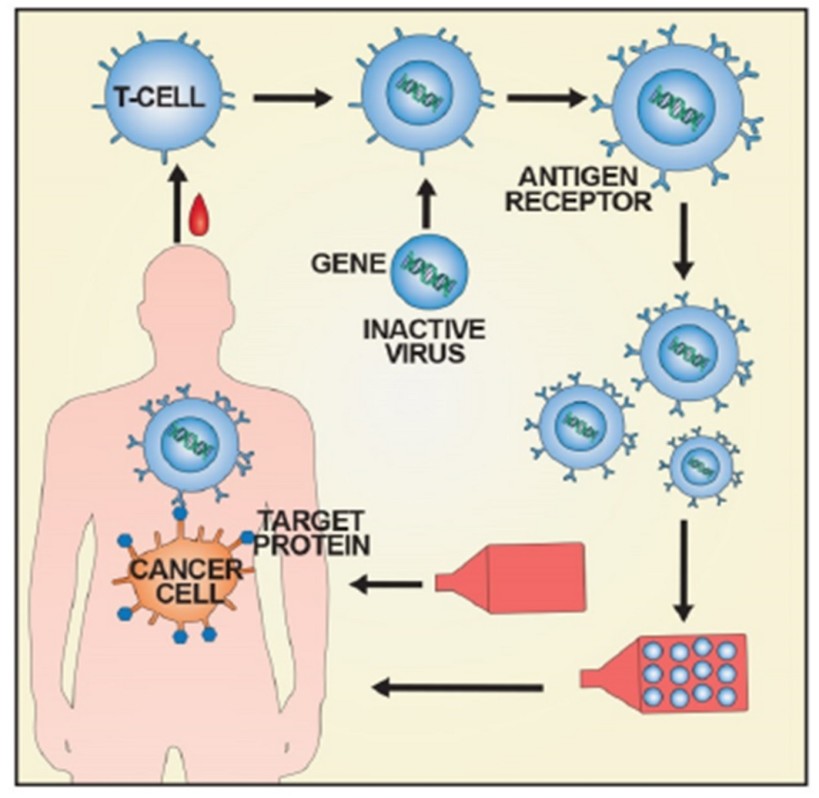 |
| ▲ CAR-T의 투여과정. (사진=식품의약품안전처) |
첨단재생바이오법은 첨단바이오의약품 특성에 맞는 차별화된 안전관리와 제품화 지원을 위해 지난해 8월 시행됐다. 첨단바이오의약은 세포치료제·유전자치료제 등 살아있는 세포·조직이나 유전물질 등을 원료로 한 의약품을 말한다.
식약처에 따르면 키메라 항원 수용체 T세포는 면역세포(T세포)의 수용체 부위와 암세포 표면의 특징적인 항원 인식 부위를 융합한 유전자를 환자의 T세포에 도입한 것으로 암세포의 표면 항원을 특이적으로 인지해 공격하는 기능을 갖는다.
킴리아주는 환자에게서 채취한 면역세포 표면에 암세포의 특정 항원을 인지할 수 있도록 유전정보를 도입한 후 환자의 몸에 주입하는 방식의 항암제다.
이 약은 다른 치료제를 선택하는 것이 제한적인 재발성·불응성 혈액암 환자에게 한 번의 투여로 개선된 유익성을 보인 혁신적 면역세포 항암제다. 미국에서는 획기적 의약품, 유럽에서는 우선순위의약품으로 각각 지정된 후 허가받았다.
식약처는 “첨단재생바이오법의 심사기준에 따라 신청 의약품에 대한 품질, 안전성·효과성, 시판 후 안전관리계획 등에 대해 과학적으로 철저하게 심사·평가했다”며 “혈액암 분야 의료현장 전문가 등이 포함된 중앙약사심의위원회에서 해당 제품의 허가 타당성과 제도 부합성에 대한 자문을 거쳤다”고 말했다.
이어 “이 약은 첨단재생바이오법에 따른 장기추적조사 대상 의약품으로 이상사례 현황에 대해 투여일로부터 15년간 장기추적해야 하며 최초 판매한 날부터 1년마다 장기추적 조사한 내용과 결과 등을 식약처에 보고해야 한다”고 덧붙였다.
식약처는 “이번 품목 허가가 대체의약품이 없거나 표준치료법이 확립되지 않은 재발성·불응성 혈액암 환자에게 새로운 치료 기회를 제공할 수 있을 것”이라며 “앞으로도 첨단바이오의약품의 세포 채취부터 사용 후 단계까지 안전하게 관리해 나가겠다”고 전했다.
'시민과 공감하는 언론 일요주간에 제보하시면 뉴스가 됩니다'
▷ [전화] 02–862-1888
▷ [메일] ilyoweekly@daum.net
[저작권자ⓒ 일요주간. 무단전재-재배포 금지]
































































![부산 덕포동 중흥S클래스 건설현장서 화재 발생...검은 연기 치솟아 [제보+]](/news/data/20220901/p1065590204664849_658_h2.jpg)
![[포토] 제주 명품 숲 사려니숲길을 걷다 '한남시험림'을 만나다](/news/data/20210513/p1065575024678056_366_h2.png)
![[포토] 해양서고 예방·구조 위해 '국민드론수색대'가 떴다!](/news/data/20210419/p1065572359886222_823_h2.jpg)
![[언택트 전시회] 사진과 회화의 경계](/news/data/20210302/p1065575509498471_939_h2.jpg)










